Adv. Funct. Mater.:配位组装异质序列寡核苷酸复合微针用于“局部-整体”联动促进糖尿病感染伤口愈合

糖尿病是一种以高血糖为特征的慢性代谢性疾病,全球受其影响的人数超过5亿。慢性难愈合创口是糖尿病的常见并发症,具有高发病率和高死亡率等特点。目前,细菌感染性糖尿病创口的常规治疗策略主要侧重于抗菌、抗炎和/或促血管生成。尽管基于生物功能材料(如纳米材料,水凝胶和微针)的治疗策略相比于商业创伤敷料能够在一定程度上加速伤口愈合,但糖尿病病人的高血糖水平加剧了伤口处细菌感染和炎症反应以及抑制血管生成,极大阻碍了生物功能材料促伤口愈合效果。迄今为止,针对伤口组织的血糖调节策略主要依赖于酶促反应消耗伤口处的葡萄糖。然而,该过程产生的过氧化氢反而增加了过度炎症反应和血管生成受阻的风险。通过拮抗胰高血糖素受体(GCGR)来降低血糖,既适用于1型/2型糖尿病患者,又能避免胰岛素抵抗等问题。然而,拮抗胰高血糖素受体的药物存在靶分子选择性差、血糖调控效果差以及潜在的毒副作用。GCGR核酸适配体有望作为一种新型高效的替代药物,且通过金属离子驱动的组装以满足高生物活性和多功能性需求。
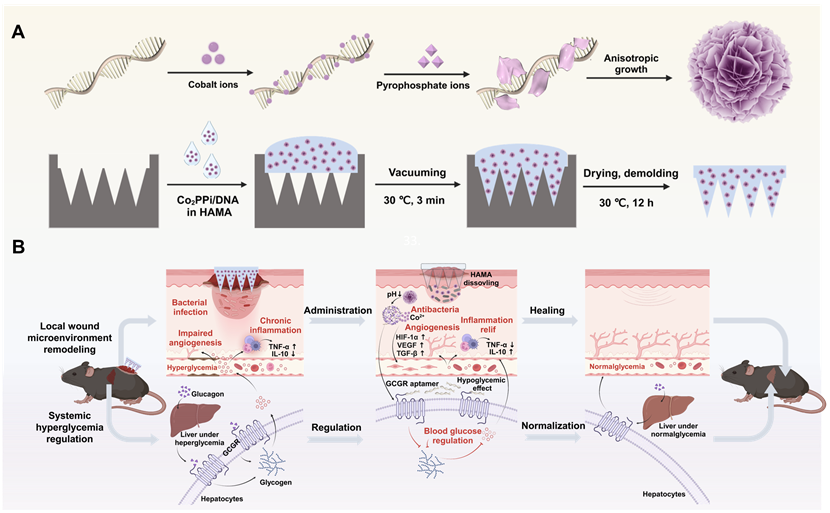
DNA纳米复合微针贴片(Co2PPi/DNA@MN)合成路线及其“局部-整体”联动促糖尿病感染伤口愈合机制示意图
目前金属离子驱动的核酸组装通常分为酶促长链核酸-焦磷酸镁配位组装和单一序列寡核苷酸-金属离子配位组装。前者通常受限于金属离子对酶活性的抑制,且核酸组装效率往往较低;后者的高组装效率仅适用于polyA 或A丰富的重复序列,且该类序列缺乏结构性和功能性。为此,同济大学胡勇教授课题组提出了配位驱动异质寡核苷酸序列组装的新策略,实现了生物活性异质序列寡核苷酸(GCGR适配体)与焦磷酸钴(Co2PPi)高效共组装,制备了一种新型分级结构的焦磷酸钴/DNA(Co2PPi/DNA)纳米材料。为提高DNA纳米结构的生物可利用度,将Co2PPi/DNA分散到可溶性微针贴片中,进行糖尿病感染伤口给药治疗。DNA纳米结构在伤口处解离,持续释放Co2+离子和GCGR适配体,其中Co2+离子消灭定植的细菌,并通过稳定HIF-1α促进血管生成;适配体经血液循环到达肝脏,与肝细胞表面GCGR结合以降低血糖水平。研究发现,适配体能够将血糖稳定在正常血糖范围内,且其全身系统的降糖能力提高了Co2+离子抗菌和促血管生成效果,并有效缓解了伤口部位的炎症反应。该工作不仅为“局部调节伤口微环境”与“系统调控血糖水平”的协同集成提供了新思路,同时为复杂疾病提供了“局部-整体”联动治疗的新范式。
研究成果近期以“Coordination of Functional Oligonucleotides Yields a Versatile Nanocomposite Microneedle Patch to Facilitate Local Wound Microenvironment Remodeling via Systemic Hyperglycemia Regulation” 为题发表在《先进功能材料》(Advanced Functional Materials)。该研究得到了国家级高层次青年人才计划、国家自然科学基金等项目资助。
论文链接:https://doi.org/10.1002/adfm.202423012

