ACS Nano:环形超分子球形核酸静息肝星状细胞 — “上游病因阻断”+“下游病理逆转”

当前,越来越多的人因饮酒、不良饮食习惯等不健康生活方式以及肝炎病毒感染等因素,导致肝纤维化发病率不断攀升。若未及时干预,肝纤维化通常发展成为肝硬化甚至肝癌。肝脏受损后,肝脏驻留细胞和浸润细胞大量分泌血小板源性生长因子-BB(PDGF-BB),通过与肝星状细胞(HSCs)表面受体PDGFR-β结合使其活化。活化后的HSCs通过分泌胶原蛋白构建致密的细胞外基质,阻碍了药物递送,导致药物浓度降低、抗纤维化疗效减弱。因此,纤维化治疗策略主要集中在抑制肝星状细胞活化与逆转其活化状态方面。尽管二者的协同作用有望提升疗效,但通过纳米医学实现这种协同仍面临挑战。临床上常用的抗体可以在一定程度上逆转纤维化,但存在成本高、批次间差异大、化学稳定性低、免疫原性等问题。与之不同的是,PDGF-BB适配体,一种单链线性功能DNA寡核苷酸,不仅对PDGF-BB具有高亲和力,而且克服了抗体的上述问题,有望推动抗纤维化治疗发展。考虑到线性核酸易被核酸酶降解,通过将线性核酸围绕纳米颗粒内核进行径向组装成球形核酸(SNAs),可延长其体内半衰期。然而,现有纳米颗粒内核通常对炎症微环境缺乏响应性,限制了其在炎症相关疾病治疗中的应用。此外,核酸外壳的结构与功能仍有待优化,以同时增强其核酸酶抗性和分子识别能力。
为此,同济大学胡勇教授课题组将超分子组装纳米颗粒内核的策略与碱基配对环化核酸外壳的策略相结合,构建了环形超分子球形核酸(cSNA)用于肝纤维化治疗。首先,通过氨基甲酸酯键将苯硼酸基团功能化聚-ʟ-赖氨酸(PLL),并利用氮-硼配位与胶原酶I和牛血清白蛋白(BSA)组装。随后,用6-马来酰亚胺基己酸N-羟基琥珀酰亚胺酯(EMCS)对所得超分子纳米颗粒核心进行修饰,以偶联携带巯基的环状PDGF-BB适体,并将RXFP1激动剂ML-290载入蛋白疏水链中。制备得到的MB/C@cSNA倾向于在肝组织中富集,并在高ROS水平下解离为功能组分。随后,释放的胶原酶I可破坏纤维化肝脏中的ECM屏障,促进后续纳米颗粒渗透。更重要的是,环化后的适配体表现出更强的核酶耐受性和PDGF-BB结合能力,在阻断PDGF-BB/PDGFR-β信号介导的HSC活化中效果显著(上游病因阻断)。同时,ML-290通过激活RXFP1信号将促纤维化Ly6Chi巨噬细胞转化为促消退Ly6Clo巨噬细胞,促进MMP2和MMP9分泌,分别诱导aHSCs失活与凋亡(下游病理逆转)。该研究推动了球形核酸与超分子化学、DNA环化技术的创新融合,提出了上下游联动静息肝星状细胞的抗纤维化的策略,解析了PDGF-BB适配体和RXFP1激动剂抗纤维化的细胞与分子机制。
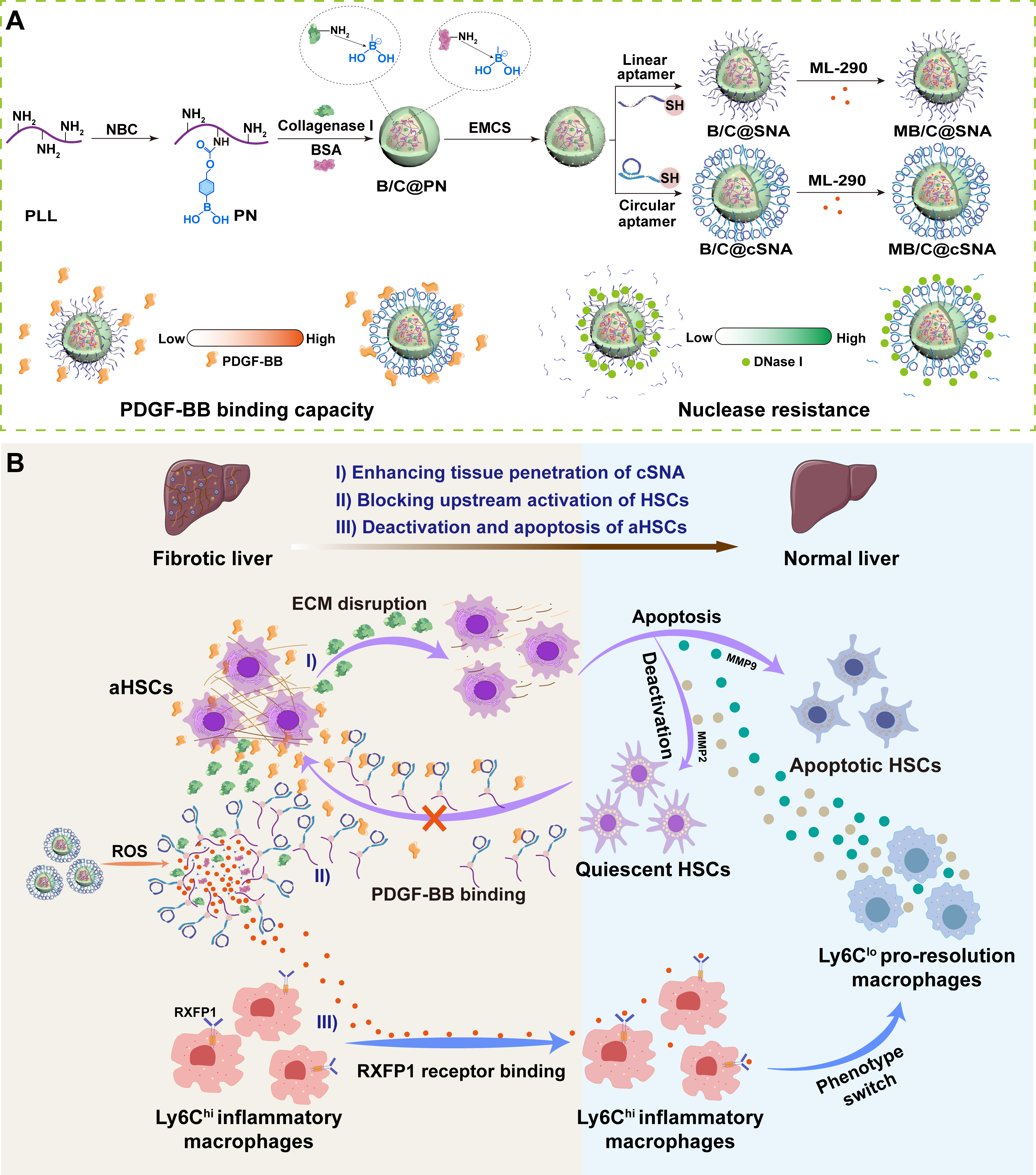
环形超分子球形核酸(MB/C@cSNA)合成路线及其抗纤维化机制示意图
研究成果近期以“Circularized Supramolecular Spherical Nucleic Acids Alleviates Liver Fibrosis through Blocking Upstream Activation and Reversing Activation State of Hepatic Stellate Cells”为题发表在《美国化学学会纳米》(ACS Nano)上。该研究得到了国家级高层次青年人才计划、国家自然科学基金等项目资助。
论文链接:https://doi.org/doi/10.1021/acsnano.4c15562.

