Nano Letters:电容式DNA生物传感器

电容传感系统具有高灵敏度和低功耗等特点,在电子皮肤、医疗诊断等领域展现出广泛应用前景。然而,现有电容传感器在创面适用性和生物标志物特异性等方面均面临着严峻挑战。首先,传统介电界面在创面监测应用中易引起机械损伤、微环境扰乱和愈合延迟。此外,传统介电界面还存在液体处理能力有限、无法高效利用伤口渗出液等问题。因此,亟需开发与介电界面集成的新型传感材料。水凝胶凭借其多孔结构在实现高效液体管理的同时,能保持组织相容性,是理想的候选材料。然而,传统聚合物网络缺乏对特定疾病标志物的响应能力,仍未能补偿传统介电界面缺乏靶标特异性的问题。功能性核酸(FNAs)种类丰富,可折叠形成特异性空间结构,能够选择性结合离子、蛋白质、细胞等生物标志物,在疾病诊断与靶向治疗中备受关注。FNA衍生的DNA水凝胶兼具核酸分子的生物识别功能与水凝胶的生物相容性及保湿性,但DNA材料本身电容值低,且靶标诱导的结构转变引起的电容变化微弱,难以将生物信号转化为可量化电信号。
为此,同济大学胡勇教授课题组设计出PEDOT:DNA(pDNA)水凝胶及其电容传感系统,用于糖尿病伤口微环境中特异性生物标志物监测。首先,通过碱基配对原则构建生物标志物响应型亚稳态核酸双链。随后,利用静电相互作用在DNA双链上聚合PEDOT,制备PEDOT:DNA(pDNA)复合物(Scheme 1A)。pDNA中未配对碱基的伯胺基与聚乙二醇二缩水甘油醚(PEGDE)的环氧基发生亲核加成反应交联成pDNA水凝胶网络(Scheme 1B)。将该水凝胶与柔性电极、便携式电容检测器集成,通过蓝牙无线传输模块实现智能手机端实时信号采集(Scheme 1C)。概念验证阶段,研究人员选取糖尿病伤口关键病理标志物H+、TNF-α和金黄色葡萄球菌(S. aureus)响应的FNAs制备成pDNA水凝胶。无靶标存在时,pDNA保持双链结构("开启"状态),维持导电网络,表现出高介电常数和电容值;暴露于靶标后,响应序列构象转变为i-motif或适配体结构,引发双链解离("关闭"状态),破坏导电pDNA网络,降低介电常数和电容值。该系统据此将生物信号转化为可量化电容读数。通过连续电容监测可解析pH变化、炎症状态及感染情况,有效区分感染与非感染创面,以及药物治疗不同阶段的愈合进程。因此,该研究设计的新型电容式DNA生物传感系统既能揭示疾病进展机制,又能为治疗效果评估提供有价值的反馈。
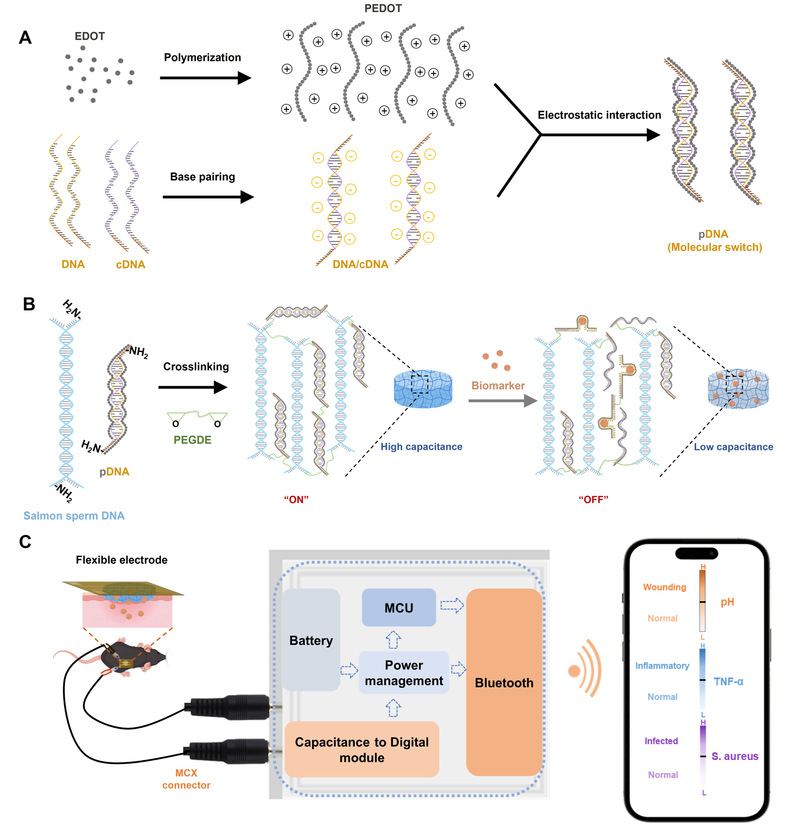
DNA水凝胶电容传感器的制备与监测机制示意图。(A) PEDOT与部分互补DNA双链静电组装;(B) 生物标志物识别触发pDNA双链体解离,降低水凝胶电容;(C)通过便携式检测器获取电容信号,经蓝牙传输至智能手机界面,实现pH、炎症与感染状态的动态分析。
该研究成果近期以“Programming Molecular Switches within Capacitive PEDOT:DNA Hydrogels for Deciphering Pathophysiological Microenvironment Dynamics in Diabetic Wound”为题发表在《纳米快报》(Nano Letters)上。
论文链接:https://doi.org/10.1021/acs.nanolett.5c05009

